
 |
| Por Facundo Valverde Profesor de Investigación Instituto Cajal, Madrid (CSIC) Selecciona un tema
Selecciona idioma  ESTRUCTURA, DESARROLLO Y LOCALIZACIÓN La corteza cerebral de los mamíferos está representada por una lámina de sustancia gris de 2 a 4 mm de espesor que cubre los hemisferios cerebrales. En el cerebro humano se trata de una formación fuertemente plegada formando surcos y circunvoluciones característicos de una geometría capaz de empaquetar el mayor número de neuronas en el menor volúmen posible. Esta lámina de sustancia gris que, extendida no ocuparía mucho más que la superficie de un periódico, es una estructura extremadamente compleja en la que los distintos órganos sensoriales aparecen representados en aquellas zonas conocidas como áreas sensoriales primarias (somática, visual, auditiva, gustativa y olfativa). La corteza cerebral está dividida en dos tipos fundamentales: el isocortex o neocortex y el allocortex. El primero corresponde a aquella parte en la que siempre puede reconocerse una estratificación en seis capas superpuestas como las hojas de un pastel de hojaldre, mientras que el allocortex, representado por el archicórtex (hipocampo y fascia detata) y el palecórtex (corteza olfativa propiamente dicha), exhiben una estructura laminar simple compuesta por tres capas. Ambos tipos corticales están separados por cierto número de áreas secundarias que han sido objeto de gran interés en el estudio de la evolución cortical. |
||
|
 |
Algunos estudios
aventuran que el neocortex, se desarrolló en el centro de
una corteza cerebral "olfativa" y primitiva, extendiéndose como una mancha de
aceite hasta llegar a ocupar el 98% de la corteza en el cerebro humano. No
parece, pues, exagerado decir que estamos aquí gracias a que aquellos primitivos
"proto-mamíferos", que sobrevivieron durante el Triásico medio, de hábitat
nocturno, cuerpo pequeño, paticortos y de hocico largo y puntiagudo,
desarrollaron un sentido del olfato tan extraordinariamente eficaz que les
permitió sobrevivir hasta dar origen a toda una ramificación evolutiva que,
durante más de 200 millones de años, llegaron a convertirse en toda la panoplia
del mamíferos que hoy pueblan la Tierra, incluida nuestra especie.
Sin embargo, a pesar de las diferencias en tamaño y forma del cerebro de
los mamíferos, desde el sentido del olfato hasta el de la visión, cada
modalidad sensorial posee un territorio cortical propio, el cual
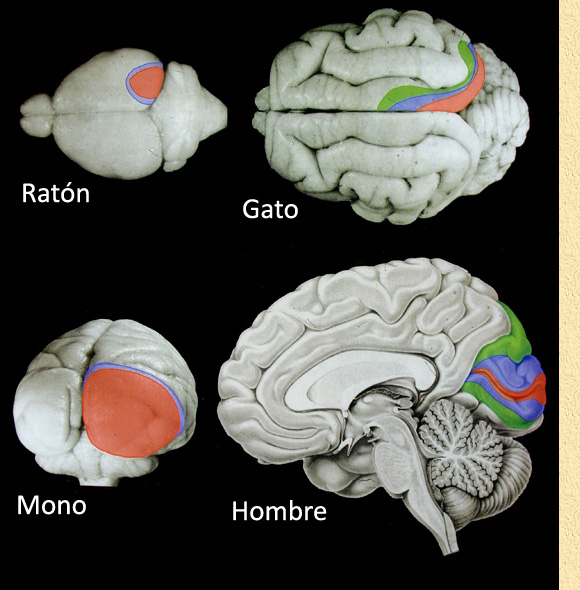
mantiene una localización constante en todos los mamíferos. ________________________ FIG. 1. Localización de la corteza visual (en rojo) y distintas áreas visuales secundarias (azul y verde) en el hemisferio derecho, en una serie representativa de mamíferos. Ratón y Gato, vista dorsal de los hemisferios cerebrales; Mono, vista posterior mostrando el polo occipital; Hombre, cara medial del hemisferio cerebral derecho, las distintas áreas visuales ocupan prácticamente todo el lóbulo occipital, manteniéndo una posición relativamente constante a lo largo de la escala animal. |
|
FIG. 1. COMPONENTES Y ORGANIZACIÓN |
|
La historia del juego del ajedrez Cuenta la leyenda que al noroeste de la India hubo un poderoso brahmán llamado Rai Bhalit que, a pesar de sus inmensas riquezas, se aburría mortalmente. Por no tener otra cosa que hacer, harto de contemplarse el ombligo o de contar las estrellas del cielo, un día ordenó a un sabio muy sabio, llamado Sissa, que inventara un juego capaz de entretenerle para el resto de sus días. Sissa inventó el juego del ajedrez y se lo enseñó a su dueño y señor quien quedó tan encantado con el juego que, deseando agradecer al sabio su creación, le dijo que le pidiese lo que quisiera ya que no pararía en gastos por muy elevados que estos fueran. A Sissa no se le ocurrió otra cosa que pedirle a su señor que, poniendo un grano de arroz en la primera casilla y duplicando en cada casilla la cantidad de la anterior, le entregase la cantidad resultante después de cubrir las 64 casillas del tablero de ajedrez: 1,2,4,8,16,32,64 . . . |
 |
 |
En nuestra historia del juego del ajedrez, si en vez de un grano de arroz pusiéramos una neurona en la primera casilla, habría que llegar a la casilla 35-36 más o menos (un poco más de la mitad del tablero) para encontrar en ella un número de neuronas parecido al de las que hay en el neocortex del hombre. Pudiera ser que estuviésemos separados de nuestros ancestros Australopithecus solo por dos o tres casillas. En la corteza cerebral humana (neocortex) existen 2,3 x 1010 neuronas [2] (veintitres mil millones de neuronas). Este número es sensiblemente mayor al obtenido en otros estudios en donde se ha estimado que el número de neuronas en la corteza cerebral es de16 mil millones [15]. Aquí parece que no acaban de ponerse de acuerdo quienes, no teniendo otra cosa que hacer, se han dedicado a contar neuronas. Digamos que 234 nos daría un número bastante aproximado. En cualquier caso, si se pudieran empalmar uno tras otro los axones de todas las neuronas corticales, se obtendría un cable que daría más de cuatro veces la vuelta a la Tierra por el ecuador o construir una red neuronal intercomunicada de más de 1015 conexiones. El número de neuronas de todo el Sistema Nervioso humano, incluido el neocortex, puede calcularse en torno a los 80-100 mil millones de neuronas. La mujer tiene un número menor, estimado en un 16% (relacionado con la variabilidad del tamaño corporal) y durante la vida se pierde otro 10%. |
Con estos datos, la posición del cerebro del elefante en nuestro tablero de ajedrez, en lo que se refiere solo al neocortex, habría de modificarse hasta situarlo en la casilla 33-34, ya que, a pesar de poseer un número total de neuronas tres veces mayor que la del cerebro humano (250 mil millones), su corteza cerebral (neocortex) sólo contiene poco más de unos modestos 5 mil millones de neuronas, incluso menos que otros primates (p.ej. el chimpancé).
El tamaño del cerebro humano aumentó considerablemente durante la evolución, dotándole de capacidades únicas como el pensamiento abstracto, el lenguaje, capacidades cognitivas superiores, etc. Las diferencias con los simios antropomorfos, concretamente con el chimpancé, fueron puestas de manifiesto por la existencia de un regulador específico de la actividad genética conocido como HARE5 que, cuando se introduce en embriones de ratón, da lugar a cerebros un 12% más grandes. Los HARE5 humanos y del chimpamcé son diferentes, siendo más activo el primero [16].
Recientemente ha sido descubierto un gen, conocido como ARHGAP11B, que pudo ser responsable del surgimiento de la inteligencia humana, al aumentar el número de neuronas y por tanto el tamaño cerebral. Este gen se encuentra en el hombre actual, en Homo neanderthalensis y en el homínido de Denísova, pero no en los chimpancés, de los que se supone nos separamos hace unos 7 millones de años. Este gen activa el crecimiento y proliferación de células progenitoras en la matriz germinal del cerebro embrionario, aumentando dramáticamente el número de neuronas en la corteza cerebral. Y ahora viene lo más interesante: cuando este gen se inserta en embriones de ratón es capaz de provocar un esbozo de "girificación" (desarrollo de circunvoluciones y pequeños plegamientos de la corteza cerebral en un cerebro normalmente liso) para dar cabida a un mayor número de neuronas [3]
Suponiendo que cada neurona puede recibir de 20 a 50.000 contactos sinápticos (hay cálculos que hablan de 100.000 o más) se ha estimado que el número de contactos inter-neuronales (sinapsis) en nuestro cerebro puede ser de 1014. En cualquier caso, la magnitud de estas cifras ha deslumbrado a más de uno y no es raro encontrar alguien con deseos de comunicar tremendismos que escribe y afirma que la capacidad de procesamiento del cerebro humano es de 500 petabytes (un petabyte es un 1 seguido de 15 ceros), como si de una vulgar computadora se tratase. Como dato curioso puede señalarse que un humilde gusano pueden tener poco más de 300 neuronas (casillas 9 o 10 de nuestro tablero de ajedrez); los pequeños mamíferos, como el ratón, de 50 a 100 millones de neuronas (casillas 27 o 28), mientras que los grandes mamíferos, como ballenas y elefantes, por razones obvias de volumen corporal, más de 200 mil millones (casillas 38 o 39), casi cuatro veces más que las que contiene la sesada del hombre. ¿Cómo sería el tamaño de nuestro cerebro si dejásemos que se duplicase sucesivamente el número de neuronas hasta alcanzar alguna de las últimas casillas del tablero?
El cerebro no funciona como si se tratase de un sistema binario con ceros y unos, ni opera a base de contactos on y off o a través de algoritmos tipo if-then-else. Cada célula nerviosa puede conectarse con un número determinado de otras neuronas. Una sola excitación sináptica sobre el extremo de una dendrita posiblemente no consiga despertar la actividad de una neurona, pero un número de sinapsis activas al mismo tiempo pueden conseguir sobrepasar el umbral de reposo y hacer que la célula receptora se dispare; es lo que conocemos como sumación espacial de fundamental importancia en la acción integradora del sistema nervioso central. Los contactos sinápticos poseen un mecanismo de potenciación o facilitación que favorecen descargas posteriores cuando una sinapsis ha sido excitada repetidas veces, lo que ha sido considerado como base para una teoría del aprendizaje y la memoria. Sabemos que las neuronas no funcionan de forma aislada sino que están conectadas formando redes neuronales formadas por cientos o miles de unidades centelleando como infinitas galaxias perdidas en la inmensidad del Universo cerebral, cada una con su particular arquitectura, cada una con su particular recuerdo, cada una con su particular individualidad. Debido a la enorme diversidad de variedades neuronales, muchas de las cuales son privativas de una determinada especie, no es posible construir un cerebro ensamblando unidades estructurales como quien coloca ladrillos para levantar un edificio. ¿Hay algo más allá que el ensamblaje de poblaciones neuronales para construir un cerebro pensante?
|
En líneas generales cada célula nerviosa o neurona posee una única fibra (axón o cilindroeje) que conduce el impulso nervioso hacia otras neuronas y un número de ramificaciones (dendritas) que actúan como receptores de los impulsos nerviosos procedentes de otras neuronas. De las seis capas en que se divide la corteza, cada una tiene su propia individualidad que viene dada por variedades celulares específicas y por sus diferentes conexiones. En el esquema básico de organización de las áreas sensoriales, las fibras provenientes de la sustancia blanca subyacente se ramifican en las capas medias III y IV. Las distintas capas o estratos están relacionadas con los componentes de las otras capas, siendo esta la filosofía sobre la que se elaboraron los conceptos de operación modular de la corteza la cual es contemplada como una organización de grupos celulares verticalmente ensamblados. Es la columna cortical que, en el hombre, puede llegar a contener hasta 105 neuronas. Esta modularidad de organización se extiende a toda la corteza siendo notables las conocidas columnas de dominancia ocular en la corteza visual [4] . FIG. 2. Formación del circuito básico en la corteza somato-sensorial del ratón. Las fibras sensoriales (F) se ramifican en las capas medias conectándose con la dendrita apical (vertical) de la célula piramidal (a) y con las dendritas de la célula intrínseca (b). El axon de esta última (en rojo) se ramifica en las capas altas de la corteza. Basado en preparaciones teñidas por el método de Golgi |
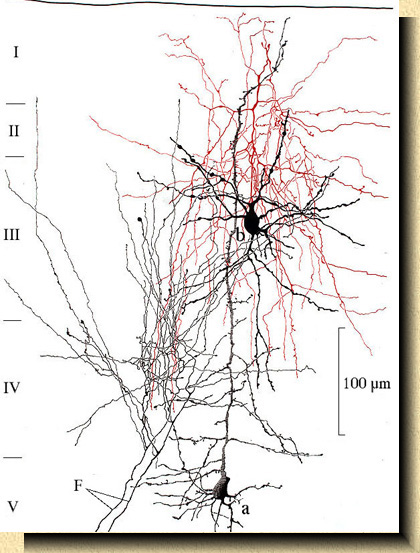 FIG. 2 |
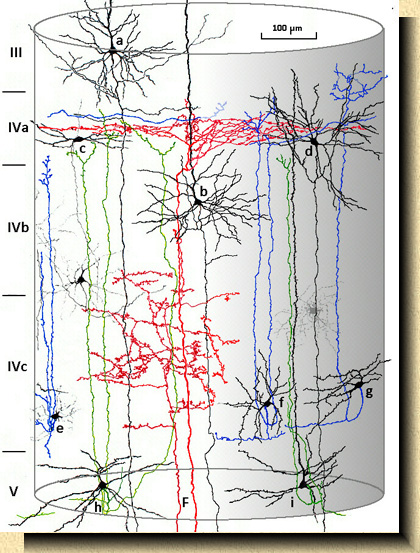 FIG.
3
FIG.
3FIG. 3 Corteza visual del mono (Macaca mulatta). Representación de una columna cortical basada en preparaciones teñidas por el método de Golgi. Diversos tipos de células piramidales (a, b), células estrelladas en la capa IVa (c,d), de axon recurrente en la capa IVc (e, f, g) y en la capa V (h, i). En rojo, fibras aferentes corticales (F) procedentes de la sustancia blanca se ramifican en los estratos IVa y IVc en que se subdivide la capa IV en primates. |
En la corteza cerebral las neuronas se
comunican por medio de uniones especializadas llamadas sinapsis (palabra
derivada del griego que significa enlace) en donde se llevan a cabo la
liberación de ciertos compuestos químicos llamados neurotransmisores
encargados de excitar (sinapsis excitadoras) o inhibir (sinapsis
inhibidoras) la acción de otras neuronas Las neuronas de la corteza cerebral fueron clasificadas en dos tipos fundamentales: células de axón largo (células de proyección a larga distancia, piramidales o tipo I) y células de axón corto (con ramificaciones axonales restringidas en la vecindad, intrínsecas o tipo II) [5], pero la joya de la corona, que sólo existe en los mamíferos, es, sin duda, la célula piramidal, mientras que las células intrínsecas, de las que se han descrito más de un centenar de variedades, son el condimento; un condimento necesario e imprescindible, por supuesto. El cuerpo de la célula piramidal se prolonga en una larga dendrita apical que asciende perpendicularmente hasta la superficie en donde acaba en un elegante penacho superficial, por lo que es capaz de recibir contactos en todas las capas por las que atraviesa. Posee un grupo de dendritas basales extendidas radialmente desde el cuerpo celular y un axón de proyección a larga distancia que desciende para penetrar en la sustancia blanca subyacente. |
|
Conocemos
un amplio espectro de variedades de células intrínsecas que pueden
caracterizarse, no solo por su morfología, sino también por la
longitud y tipo de ramificación axonal y dendrítica que poseen. Existen
variedades neuronales que, desde un punto de vista morfológico y
probablemente funcional también, son distintas para cada sujeto,
existiendo variedades celulares que no se encuentran en otras especies
por lo que la descripción de un patrón estructural único no es aplicable
a menos de recurrir a una simplificación y generalización extrema, por
supuesto carente de todo valor. No es posible construir una columna
cortical modelo que sirva para todos y cada uno de los mamíferos
[6]. FIG. 4. Área visual en la corteza cerebral del ratón (Mus musculus) mostrando diversos tipos celulares en las capas II y III. Una célula de axon ascendente (a) y una célula piramidal en la capa V (b). El axon, en rojo, de la célula "a" asciende directamente emitiendo numerosas colaterales en las capas IV y V, terminando en un plexo de colaterales terminales en la capa I. Preparación teñida por el método de Golgi. |
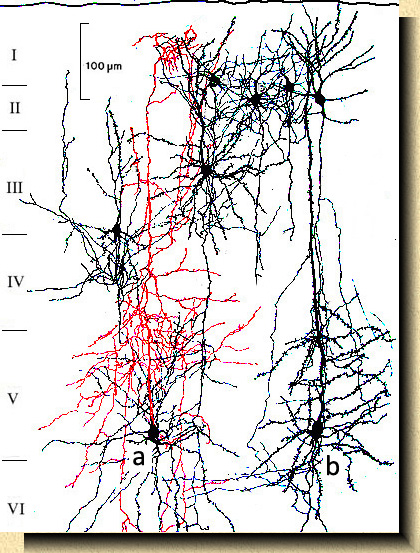 |
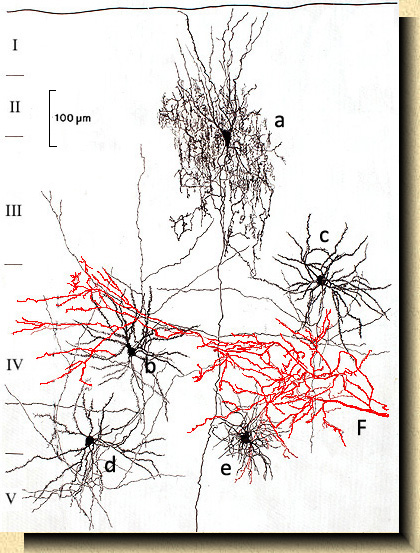 FIG. 5 FIG. 5. Corteza visual del gato (Felis catus) mostrando una célula en candelabro (a) cuyo axon, despues de formar un gran plexo pericelular, continúa con una rama descendente de proyección a larga distancia. Células estrelladas (b, c, d) con ramificaciones axonales verticales y horizontales; célula en ovillo o aracneiforme (e). La fibra aferente (F) en rojo se distribuye formando colaterales terminales en la capa IV. Basado en preparaciones teñidas por el método de Golgi. _____________________ FIG. 6. Células bipenachadas con axones de distinta extensión y morfología en la corteza cerebral del mono (Macaca mulatta). Las dos células a la izquierda localizadas en el área visual primaria o área 17; las dos células a la derecha corresponden a variedades celulares en el área visual secundaria, área 18 mostrando ramificaciones axonales extendidas prácticamente a todas las capas corticales. Basado en preparaciones teñidas por el método de Golgi. |
FIG.
4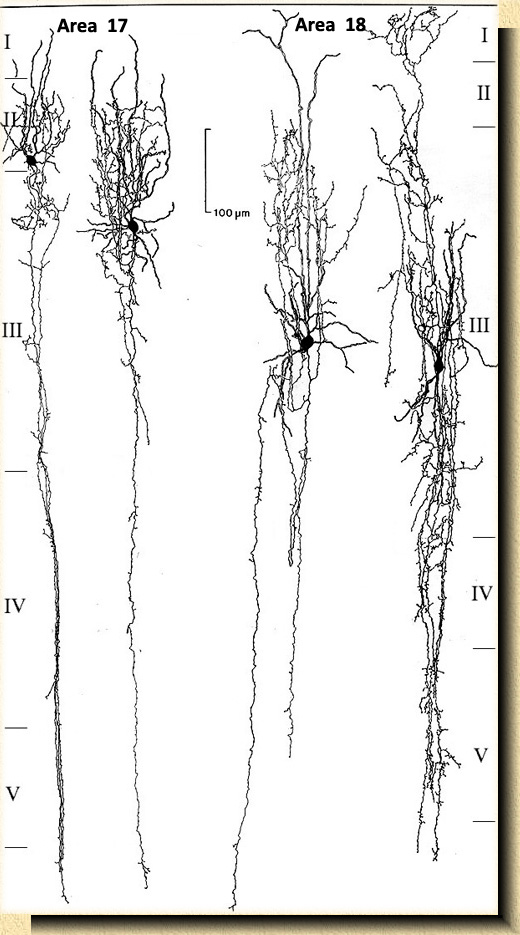 FIG.
6
FIG.
6 |
![]()
| REDES
NEURONALES. HIPOCAMPO Y MEMORIA El conjunto de la actividad neuronal no depende de las características individuales de cada célula sino de los contactos que establecen con otras células de su mismo circuito neuronal. Las conexiones sinápticas que aparecen en los modelos de redes neuronales tienen por objeto ilustrar una notable e importante propiedad: que pueden transmitir impulsos diferentes a través del mismo esquema de conexiones celulares, con lo que aumenta considerablemente la funcionalidad de los circuitos neuronales [7]. La estructura cerebral conocida como hipocampo, juega un papel fundamental al intervenir en un complejo proceso de consolidación, recuerdo y posicionamiento espacial. Durante el aprendizaje, el flujo de información daría lugar a la activación de estas redes neuronales de duración limitada (memoria a corto plazo) que pueden llegar a ser permanentes cuando las sinapsis, activadas por la repetición, se vuelven más eficaces y es en virtud de esta eficacia sináptica cuando otros influjos tenderán más tarde a atravesar estas mismas estructuras neuronales (memoria a largo plazo). Es la potenciación de larga duración o LTP (long term potentiation) que ha producido una fijación por facilitación, un aprendizaje, un recuerdo que queda archivado y que puede ser evocado, pudiendo durar toda la vida y perdurar en casos incluso de coma o anestesia profunda [8]. Es un fenómeno en el que aquella estructura cerebral conocida como hipocampo, juega un papel fundamental al intervenir en un complejo proceso de consolidación, recuerdo y posicionamiento espacial. |
FIG. 7.
Microfotografía
de una preparación teñida por el método de Golgi en la corteza visual
del mono (Macaca mulatta). Variedad de célula estrellada con
espinas de axon recurrente "en anzuelo", típica de los primates, con
axon dividido en dos ramas ascendentes (flecha) que alcanzan las capas
superficiales de la corteza. FIG. 8. Microfotografía de una preparación teñida por el método de Golgi en la corteza somato-sensorial del erizo (Erinaceus europaeus) mostrando una variedad de célula piramidal cuyo axon se origina en la dendrita apical (flecha). |
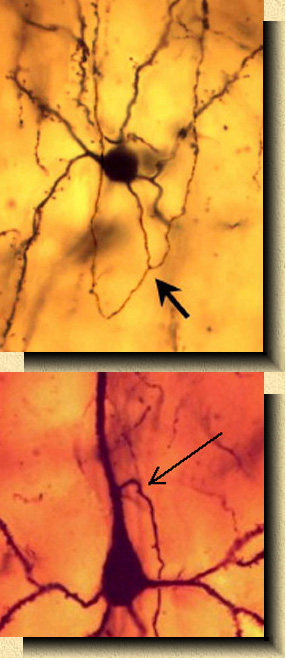 |
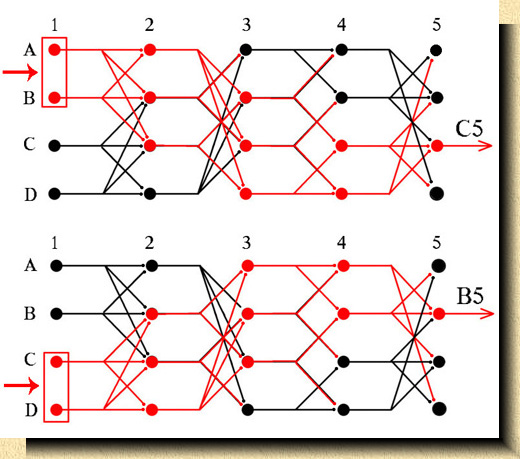 FIG. 9. FIG. 9. Red neuronal muy esquematizada. Los dos diagramas, superior e inferior, son exactamente iguales, representando las conexiones de las 20 neuronas que componen esta red. Se supone que se necesitan, como mínimo, dos sinápsis para dar lugar a la descarga de cada neurona. Con esta premisa, la entrada de un impulso por A y B (esquema superior), sólo puede recorrer el camino descargando las neuronas en rojo que le lleva a la salida por C5; si el impulso entra por C y D (esquema inferior), la salida sólo puede ser por B5. Si en vez de 20 neuronas, como en este ejemplo, imaginamos una red con cientos de miles de neuronas, las posibilidades de diferentes circuitos funcionales prácticamente acarician el infinito. Basado en los esquemas propuestos por Eccles. |
De
todas formas, estos mecanismos de consolidación o fijación no son
inmediatos; son conocidos los casos de pacientes que habiendo sufrido un
traumatismo grave con pérdida del conocimiento, su hipocampo no tuvo
tiempo de registrar (consolidar) lo sucedido por lo que no recordarán
nada de su accidente cuando despierten. Un caso paradigmático es el de
un paciente, conocido bajo las siglas H.M., sometido en 1956, a la edad
de 27 años, a una operación en la que se le reseccionó bilateralmente
gran parte del hipocampo y algunas estructuras cerebrales adyacentes. La
operación tenía por objeto curar una epilepsia rebelde que padecía desde
los diez años a consecuencia de un traumatismo
[9].
Después de su operación dejó de tener crisis epilépticas pero presentó una severa amnesia para los recuerdos recientes que le hizo vivir como en un presente permanente. Conservó todos sus recuerdos anteriores pero era incapaz de recordar lo que acababa de hacer pocos segundos antes por lo que, después de cuarenta años, estuvo haciendo el mismo crucigrama día tras día sin recordar que ya lo había hecho cientos de veces y leyendo la misma revista una y otra vez. El caso H.M., quizá el paciente más famoso de la historia de la Neurología, ha dado lugar a una extensísima bibliografía. Murió a la edad de 82 años y su cerebro, que ha sido exhaustivamente estudiado, representa un material que deja un legado de valor incalculable para el estudio de los procesos de almacenamiento y recuperación de recuerdos y funciones cerebrales relacionadas con la memoria. |
|
El hipocampo
es una parte del cerebro escondida en las profundidades del lóbulo
temporal. Aparentemente tiene una estructura bastante más sencilla y
ordenada que la de las capas de la neocorteza, como puede apreciarse
observando la imagen que sirve de base al título de este ensayo. El
hippocampo es una estructura implicada en la memoria episódica y
espacial y tiene un papel fundamental en la formación y consolidación de
nuevos recuerdos. Su lesión provoca severos trastornos de amnesia
anterógrada (formación de nuevos recuerdos) y retrógrada (evocación de
sucesos y experiencias anteriores). Se sabe que el hipocampo está
implicado en la transferencia de los recuerdos a otras regiones
cerebrales para su archivo permanente. En realidad el hippocampo es como un cajón de sastre al que le han caído encima todos los males para los que no se ha encuentra, a veces, una explicación clara. Ha sido implicado en multitud de trastornos y enfermedades mentales, del sueño y del comportamiento de distinta naturaleza, hasta procesos de envejecimiento, epilepsia, estrés, enfermedad de Alzheimer y otras patologías cerebrales. Hasta hay estudios que pretenden haber demostrado que los taxistas de Londres tienen el hipocampo más grande debido a las enormes facultades de retentiva callejera que deben poseer. En el hipocampo se localizan células específicas que forman un sistema de posicionamiento o "mapa cognitivo" (que ha venido en mal-llamarse GPS cerebral), que permite conocer y recordar la situación y el camino seguido para alcanzar un determinado lugar. Las relaciones del hipocampo con la vecina corteza entorhinal han aclarado cómo estos conjuntos de células pueden ejecutar funciones cognitivas superiores. Este sistema de posicionamiento, afectado por lesión en el hipocampo y corteza entorhinal en la enfermedad de Alzheimer, nos explica porqué estos enfermos pierden su capacidad de reconocer el entorno, olvidar su camino de retorno y sufrir graves pérdidas de memoria . Los autores de estos estudios han sido galardonados con el premio Nobel de Medicina o Fisiología 2014 [10]. |
![]()
ESPINAS DENDRÍTICAS. DEPRIVACIÓN SENSORIAL.
|
Las
dendritas de las células nerviosas poseen unas estructuras conocidas
como “espinas dendríticas” que, como su nombre indica, semejan las
espinas que crecen a lo largo de los tallos (las dendritas) de los
rosales, pero en número mucho mayor. Las espinas dendríticas son
estructuras que aumentan considerablemente la superficie de contacto de
las neuronas. Su forma es la de una fina protuberancia o pedículo de una
a tres micras (1 micra = 0,001 mm) de longitud, acabado en una pequeña
cabeza esférica de forma y tamaño variable semejantes a un hongo. Las
ramificaciones dendríticas de una sola neurona pueden contener cientos o
miles de espinas que reciben las conexiones sinápticas excitadoras de
otras tantas fibras nerviosas. Hoy sabemos que más del 80% de las conexiones neuronales en la corteza cerebral se realizan a través de contactos sobre las espinas dendríticas. Son unas estructuras dinámicamente muy activas y su mantenimiento y plasticidad, supuestamente implicados en la memoria y el aprendizaje, hace que puedan aparecer, moverse o variar de forma y tamaño en escasos segundos. En la capa V de la corteza visual residen las células piramidales propias de esta capa cuyas dendritas apicales ascienden verticalmente hasta la superficie. Están densamente provistas de numerosas espinas dendríticas, atravesando la zona donde se distribuyen las ramificaciones de fibras ópticas, y en donde reciben numerosos contactos directos. Recientemente se ha descubierto que el gen SRGAP2, implicado en el desarrollo de la corteza cerebral durante la evolución [11], es capaz de promover un mayor crecimiento y densidad del número de espinas dendríticas extendiendo su período de maduración con las consecuencias lógicas de mayor funcionalidad sináptica en procesos de memoria y aprendizaje [12]. |
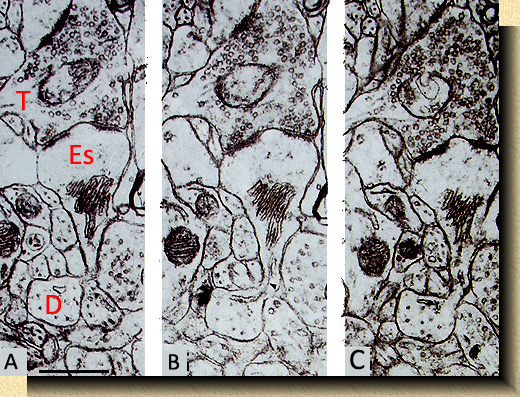 FIG. 10. FIG. 10. Imagen del microscopio electrónico mostrando una espina dendrítica (Es) unida por un fino pedículo a una delgada dendrita (D) cortada transversalmente en la corteza visual del ratón (Mus musculus). Sobre la espina aparece una terminación (T) cargada de vesículas sinápticas haciendo sinápsis (contactos engrosados) sobre la espina. Las espinas dendríticas se reconocen específicamente por la presencia de divertículos aplanados (el aparato de la espina) frecuentemente en continuidad con los microtúbulos de la propia dendrita. A, B y C es la secuencia de tres cortes sucesivos. La escala en A representa una micra. |
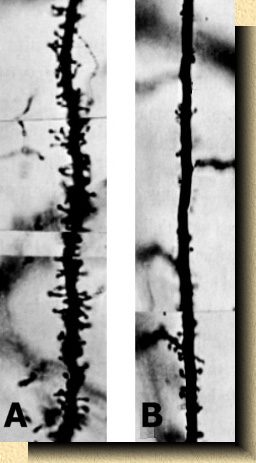 FIG. 11. Fig. 11. Microfotografías de segmentos de 50 micras de dendritas apicales de células piramidales en la capa IV en la corteza visual del ratón (Mus musculus). A, ratón normal de un mes de edad con abundantes espinas dendríticas; B, ratón mantenido en oscuridad total desde su nacimiento durante 24 días mostrando ausencia casi total de espinas dendríticas. Tinción por el método de Golgi. |
Gracias a los
recientes avances utilizando modernas técnicas (microscopio de dos
fotones, transferencia genética, imagen de Calcio) se ha sabido que las
espinas dendríticas son estructuras muy sofisticadas, que han aportado
bases fundamentales para entender la plasticidad estructural del
cerebro. Posiblemente, en el tiempo de leer estas líneas algunas espinas
dendríticas de neuronas en nuestro cerebro se hayan estremecido,
cambiando ligeramente de forma o tamaño y su actividad se haya visto
reforzada. Quizás, también, hayan crecido unas pocas, como los hongos
que brotan tras la lluvia otoñal y, si uno si acuerda de lo que ha
leído, es porque las espinas dendríticas y sus conexiones se han
estabilizado y reforzado
[13]. Por el contrario, los experimentos de deprivación visual pusieron de manifiesto que ratones mantenidos en oscuridad desde su nacimiento presentaban una disminución del número de espinas dendríticas en las células piramidales de la zona visual de la corteza cerebral. Tal disminución era altamente significativa en el primer mes de vida del animal (el llamado "período crítico" o "sensible") después de que estos abrieran los ojos (el ratón abre los ojos normalmente en torno al día 13-14). En comparación, los animales mantenidos en oscuridad desde su nacimiento por períodos prolongados de tiempo, mostraban también una disminución del número de espinas si bien la variación no era tan acusada como en períodos juveniles. Según los datos obtenidos, se demostró que, pese a existir cierta tendencia a la recuperación del número de espinas, después de vueltos a la normalidad, quedaba una población de neuronas en la que el número de espinas nunca llagaba a alcanzar cifras normales (Fig. 12, histograma de frecuencia, grupo 20 + 4 días oscuridad + normal) [14]. |
|
Fig. 12. Histograma de frecuencias. (Derecha) Relación del número de espinas dendríticas por segmento de 100 micras en dendritas apicales de células piramidales de la capa V en la corteza visual de ratones normales (en rojo), mantenidos en oscuridad total desde su nacimiento (en negro) y mantenidos en oscuridad total desde su nacimiento y vueltos a condiciones normales (en azul) por los períodos indicados. Comparando el número de espinas por segmento en animales mantenidos en oscuridad y controles antes de que abran los ojos, no hay diferencia apreciable (A). Cuando los ratones abren los ojos se aprecia un aumento explosivo en el número de espinas dendríticas; en tan sólo 10 o 12 días se duplica el número de espinas (B), quedando el valor medio en torno a 90-100 espinas por segmento alejado del valor medio encontrado en los animales crecidos en oscuridad (valores medios entre 60 y 70). Lo interesante de este estudio es que en los ratones mantenidos en oscuridad desde su nacimiento durante 20 días y retornados a condiciones normales durante 4 días (B, histograma en azul) se distinguen claramente dos poblaciones de neuronas piramidales: un grupo alcanza valores cercanos a los normales (parte derecha del histograma en azul), mientras otro grupo mantiene un número de espinas muy bajo (óvalo señalado por una flecha). |
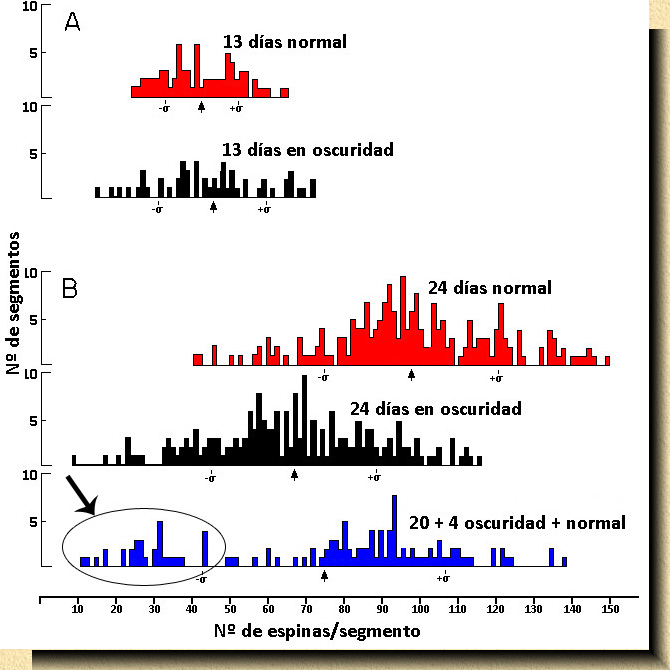 FIG. 12. |
|
|
Fig.
13. Secuencia de valores medios. (Izquierda) Este gráfico muestra los valores medios del número de espinas por segmento de 100 micras en las dendritas apicales de células piramidales con relación a las distintas edades y condiciones estudiadas. En el ratón normal (círculos blancos) los valores medios siguen el trazado de una curva sigmoidal hasta quedar estabilizados en valores entre 80 y 90. En ratones mantenidos en oscuridad desde su nacimiento (círculos negros) los valores medios quedan entre 50/60 durante el período crítico (critical period), recuperando posteriormente valores casi normales (80-90 espinas/segmento). Ratones mantenidos en oscuridad y vueltos a condiciones normales después de 20 dias (círculos en blanco y negro) recuperan rápidamente valores próximos al de los ratones normales. (Copia de la imagen ligeramente modificada de la referencia nº 14) |
Resumiendo:
Cuatro aspectos importantes pueden derivarse de los estudios de la deprivación sensorial visual en el ratón:
1) En ratones mantenidos en oscuridad completa desde su nacimiento se produce una disminución estadísticamente significativa en el número de espinas dendríticas, supuesta diana de fibras aferentes del núcleo geniculado lateral, en los tallos apicales de células piramidales de la capa V en la corteza visual, área 17, del ratón.
2) Existe un "período crítico" de tiempo limitado en el que el dearrollo de determinadas estructuras cerebrales (espinas dendríticas) puede quedar suspendido temporalmente. En ratones, este período crítico parece extenderse desde el momento en que los animales abren los ojos (día 13-14) hasta aproximadamente 10-30 días despué, en donde la disminución de espinas es claramente significativa con relación a los valores normales. La recuperación del número de espinas aparenta alcanzar lentamente valores casi normales.
3) Si durante el período crítico los animales vuelven a su vida normal (ritmo día-noche), la recuperación del número de espinas es muy rápida, alcanzando valores casi normales (activity dependent plasticity).
4) En ratones, la deprivación de luz realizada en el adulto, no provoca disminución del número de espinas.
| En realidad se desconoce el lugar donde se almacenan la memoria o los recuerdos. Posiblemente el proceso tenga lugar en amplias zonas de la corteza cerebral quedando almacenados en forma de engramas temporo-espaciales que se “disparan” por algún mecanismo que aun no conocemos. Es muy posible que nuestros recuerdos sean evocados gracias a ciertas “claves” que pueden estar representadas por una palabra, un sonido, una imagen, incluso un olor. Quizás una fragancia primaveral nos traiga una avalancha de recuerdos poniendo en marcha toda una circuitería cerebral escondida en lo más profundo de nuestro cerebro. Estas actividades neuronales han de tener como base algún cambio duradero que se produce en la estructura fina del sistema nervioso durante la consolidación y el recuerdo. En la Anatomía de la Memoria sólo hemos esbozado unos pequeños aspectos del funcionamiento de esa máquina tan especial y que tanto le cuesta mostrarnos sus secretos: nuestro cerebro. Esperemos que algún día nos revele claramente su verdadera estructura y función para poder así corregir y ajustar sus errores. |
| REFERENCIAS (1) Jerison,H.J. (1990) Fossil brains and the evolution of neocortex. In: The Neocortex. Ontogeny and Phylogeny. Ed. by B.L.Finlay, G.Innocenti and H.Scheich. Plenum Press, New York and London. Pp. 5-19. (2) Pakenberg,B. and Gundersen,H.J. (1997) Neocortical neuron number in humans: effects of sex and age. Journal of Comparative Neurology, 384:312-320. (3) Florio,M. and cols. (2015) Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science Express, February 26, pp. 1-9. (4) Hubel,D.H. and Wiesel,T.N. (1962) Receptive fields, binocular interaction and functional architecture in the cat's visual cortex. Journal of Physiology, 160:106-154. (5) Cajal,S.R. (1891) Sur la structure de l'ecorce cérébrale de quelques mammifères. La Cellule, Vol. VII. (6) Valverde,F. (1991) The organization of the striate cortex. In: Vision and Visual Dysfunction 3. Neuroanatomy of the visual pathways and their development. Ed. by B.Dreher and S.R.Robinson. MacMillan Press. Pp. 235-277. (7) Eccles,J. (1970) Facing Reality: Philosophical Adventures by a Brain Scientist. Berlin, Springer. (8) Bliss,T. and Lømo,T. (1973) Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path. Journal of Physiology, 232:331-35. Scoville,W.B. and Milner,B. (1957) Loss of recent memory after bilateral hippocampal lesions. Journal of Neurology, Neurosurgery and Psychiatry, 20:11-21. (10) Moser,E.I., Kropff,E. and Moser,M.-B. (2008) Place cells, grid cells and the brain's spatial representation system. Annual Review of Neurosciences, 31:69-89. (11) Dennis,M.Y. and cols. (2012) Evolution of human-specific neural SRGAP2 genes by incomplete segmental duplication. Cell, 149:912-922. (12) Charrier,C. and cols. (2012) Inhibition of SRGAP2 function by its human-specific paralogs induces neoteny during spine maturation. Cell, 149:923-935. (13) Sala,C. and Segal,M. (2014) Dendritic spines: The locus of structural and functional plasticity. Physiol.Rev. 94:141-188 (2014) (14) Valverde,F. (1971) Rate and extent of recovery from dark rearing in the visual cortex of the mouse. Brain Research, 33:1-11. (15) Herculano-Houzel,S. (2009) The human brain in numbers: a linearly scaled-up primate brain. Frontiers in Human Neuroscience, 3:1-11. (16) Lomax Boyd,J and cols. (2015) Human-Chimpanzee differences in FZD8 enhancer alter cell-cycle dynamics in the developing neocortex. Current Biol., 25:772-779.
Enlaces de interés: -
Instituto Cajal. Cien años de Historia. |
| Ir a la página de INICIO |
|
|